탄수화물과 단백질뿐만 아니라 지방도 인슐린 분비와 밀접한 관련이 있습니다. 당뇨병 환자는 특히 고지혈증으로 인한 합병증을 경계하므로 지방이 인슐린 분비를 조절하는 방식을 이해하는 것이 중요합니다. 지난 글을 못 보신 분들은 아래 링크를 클릭해주세요! 이제 지방과 인슐린 분비에 대해 공부해볼까요?
☞ 이전 기사 바로가기
(인슐린은 어떻게 분비되는가?)
(탄수화물과 인슐린 분비)
(단백질 및 인슐린 분비)
지방대사와 인슐린 분비
지방 및 비에스테르화 지방산(NEFA)은 인슐린 분비에 중요하지만 종종 이상지질혈증과 관련된 세포외 지방 수치의 상승은 인슐린 저항성, 베타 세포 기능 장애 및 제2형 당뇨병과 밀접한 관련이 있습니다. 금식 또는 식사 거르기지방은 미토콘드리아에서 베타– 산화적(β-산화) 대사에 의한 ATP 생성. 수많은 효소와 셔틀 메커니즘이 미토콘드리아로의 지방 유입에 관여합니다. 세포 비에스테르화 지방산(NEFA)은 먼저 아실-CoA 합성 효소(ACS)에 의해 장쇄 아실-CoA(LC-CoA)로 전환됩니다. 그런 다음 carnitine palmitoyltransferases 1 및 2(CPT1 및 CPT2)의 작용을 통해 미토콘드리아 매트릭스로 전달되어 CO2로 산화됩니다.2나트륨탈수소효소, 탈수소탈수소효소2, 마지막으로 ATP(그림 1).췌장 베타 세포에서는 영양분이 풍부할 때, NEFA는 세 가지 다른 대사 신호 메커니즘을 통해 인슐린 분비에 영향을 미칠 수 있습니다. 이 “삼지창 모델”은 TCA/말로닐-CoA 대사 신호, GL/NEFA 주기 및 G 단백질 결합 수용체(GPR)의 직접적인 활성화입니다(그림 2).
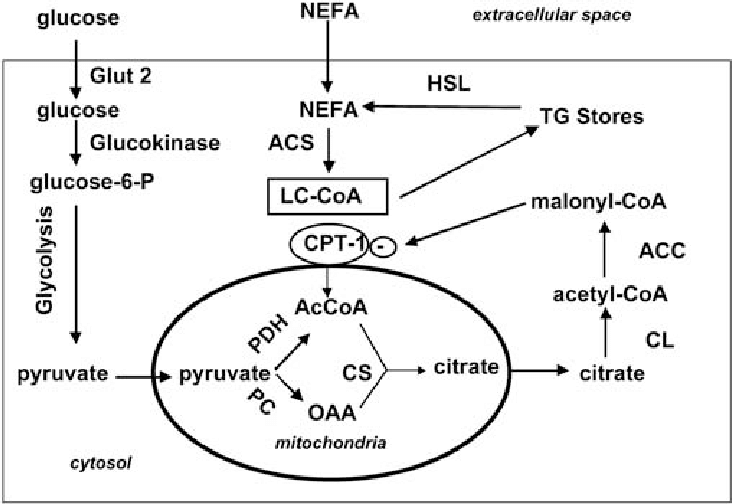
*원천: 당뇨병학2003년 10월 46(10):1297-312.
TCA/말로닐-CoA 대사
CPT 활성 및 TCA/malonyl-CoA 대사는 β-산화의 조절과 밀접한 관련이 있습니다. 탄수화물이 NEFA를 초과하면 CPT는 아세틸-CoA 카르복실라제(ACC)에 의해 TCA 회로의 중간체인 구연산염에서 방출되는 말로닐-CoA에 의해 직접적으로 억제됩니다. CPT가 억제되면 지방은 β-산화에 의해 이용되지 못하고 세포질에 지방이 축적되어 인슐린 분비를 촉진하며 그 작용기전은 다음과 같다. 하나) 조절 이온 채널 단백질의 활성 변경 및 2) Ca2+ 3) LC-CoA 및 디아실글리세롤(DAG)과 같은 인슐린 분비 촉진 지질을 생성하고, 4) 인슐린 소포와 세포막의 상호 작용을 증가시켜 인슐린 분비를 증가시킵니다.
NEFA 대사의 또 다른 중요한 요소는 AMP-AMP 활성화 단백질 키나아제(AMPK). AMPK는 세포 에너지 상태에 민감하며 AMP:ATP 비율이 높을 때 활성이 증가합니다. ACC 억제, 말로닐-CoA 데카르복실라제(MCD) 활성 증가, 말로닐-CoA 감소, 베타 산화를 촉진합니다. 그러나 충분한 영양 섭취로 인해 ATP가 많이 생성되면 AMP:ATP 비율이 감소하여 AMPK의 활성이 감소합니다. 베타 산화도 감소되어 세포질에 지방이 축적됩니다.
GL/NEFA 주기
β 세포에서 GL/NEFA(glycerolipid/non-esterified fatty acid) 주기는 또한 인슐린 세포외 배출에 영향을 미치고 포도당과 NEFA 대사의 수렴점 역할을 합니다. 포도당의 약 25%가 세포에 들어간 후에 생성되는 3-포스포글리세롤(Gly-3-P)과 지방분해에 의해 생성되는 비에스테르화 지방산(NEFA) 및 글리세롤 지질(GL), 장쇄 아실-CoA(LC-CoA) ) 혈당 상승에 대한 인슐린 분비 반응을 더욱 증폭시킵니다.NEFA의 존재 하에 포도당이 들어가면 β 세포에서 NEFA 에스테르화와 지방분해가 동시에 일어날 수 있지만, 베타 산화가 억제된다고 합니다. 이것은 인슐린 소포 또는 세포외 배출의 구성에 기여하는 인슐린 자극 지질 신호 분자를 제공합니다. 구체적으로, DAG 및 LC-CoA는 PKC 활성을 촉진하면서 MUNC13, SNAP25(synaptosome-associated protein 25) 및 synaptotagmin과 같은 주요 소포 프라이밍 및 도킹 단백질의 엑소사이토시스를 촉진합니다. GL/NEFA 주기의 주요 이점은 포도당이 Gly-3-P로 전환되어 β 세포를 보호하고 과산화 대사에서 포도당 유래 탄소를 방출한다는 것입니다. 또한 TCA 주기 및 산화 과정과 독립적인 인슐린 분비의 보상적 대체 메커니즘을 제공합니다.
G 단백질 결합 수용체(GPR)에 의해 조절되는 인슐린 분비
지방은 또한 베타 세포에서 많이 발현되는 G 단백질 결합 수용체(GPR)를 활성화하여 인슐린 분비를 증가시킵니다. GPR40(FFAR1), GPR41(FFAR3), GPR119 및 GPR120(FFAR4)은 β 세포 생리에 중요하며 이들의 발현을 줄이면 NEFA 유발 인슐린 분비가 감소하는 것으로 보고되었습니다. NEFA에 의한 GPR 활성화는 소포체(ER)에서 Ca2+를 방출함으로써 인슐린 분비를 향상시키는 것으로 생각되며 L-타입 Ca2+ 채널의 포도당 매개 활성화에 의존하는 것으로 보입니다. 실제로 개발 중인 GPR 작용제는 제2형 당뇨병 환자의 HbA1c 수준을 감소시키고 저혈당증을 개선하는 것으로 보고되었습니다. 또한, ω3 지방산을 포함한 식이 보충제는 비만 쥐 모델에서 인슐린 감수성과 항염증 효과를 증가시키는 것으로 보고되었으며, 이는 ω3 지방산과 GPR120 사이의 상호작용에 의해 촉진되는 것으로 보입니다.
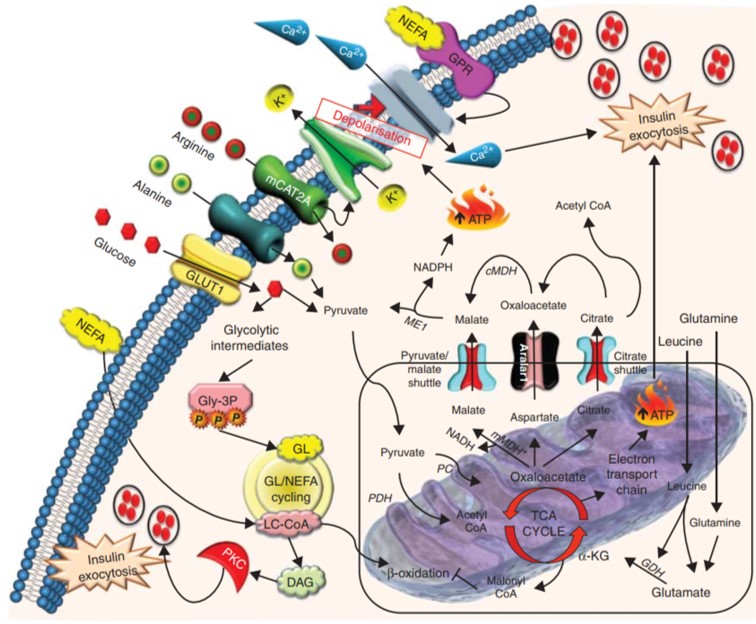
*원천: 내분비학 저널 (2014) 221, R105-R120
따라서 지방은 인슐린 분비를 촉진하지만 만성 고지혈증과 고혈당증은 베타세포를 손상시킨다. 그렇기 때문에 제2형 당뇨병과 전당뇨병이 있는 사람들은 식단을 조절해야 합니다. 다음 글에서는 고지혈증이 베타세포의 세포사멸을 유도하는 기작에 대해 알아보겠습니다.
인용하다
내분비학 저널 (2014) 221, R105-R120.
당뇨병학2003년 10월 46(10):1297-312.

